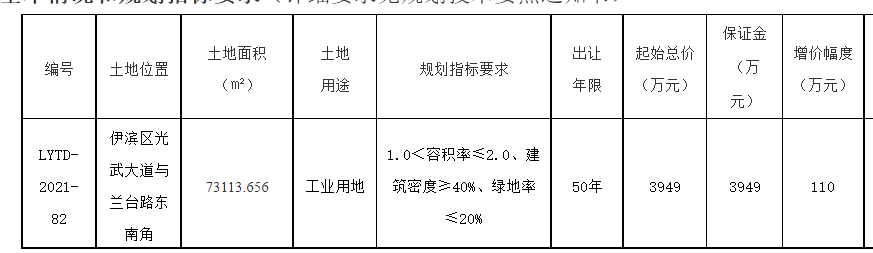
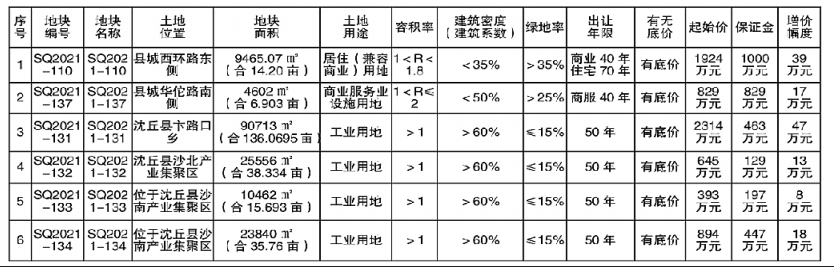
日前,國家藥品監督管理局會同國家衛生健康委員會組織修訂的《醫療器械臨床試驗質量管理規范》(以下簡稱“《規范》”)對外發布。
《規范》共九章66條,涵蓋醫療器械臨床試驗全過程,包括醫療器械臨床試驗的方案設計、實施、監查、稽查、檢查,數據的采集、記錄、保存、分析、總結和報告等。
據悉,2016年原國家食品藥品監督管理總局會同原國家衛生和計劃生育委員會發布了《醫療器械臨床試驗質量管理規范》(國家食品藥品監督管理總局令 第25號)(以下簡稱“2016年《規范》”)。該規范的實施,確立了醫療器械臨床試驗的準則,對加強醫療器械臨床試驗管理、維護受試者權益起到了積極的作用。2019年,根據臨床試驗發展需要,國家藥監局啟動對2016年《規范》修訂工作,2021年就修訂草案對外公開征求意見。
官方發布解讀表示:此次新修訂《規范》更加明確和強調各方職責,一是突出申辦者主體責任,引入了風險管理理念,明確規定申辦者的質量管理體系應當覆蓋醫療器械臨床試驗的全過程;二是強化醫療器械臨床試驗機構要求,臨床試驗機構應當建立臨床試驗管理組織架構和管理制度;三是強調研究者職責,研究者應當按照《規范》和相關法律法規的規定實施醫療器械臨床試驗。
同時,為了適應體外診斷試劑產業和監管需求,將體外診斷試劑臨床試驗質量管理要求納入《規范》中,體現臨床試驗質量管理理念與要求的統一性。
《規范》還結合產業需求和監管實際,切實解決當前反映較為集中的問題。刪除了“醫療器械臨床試驗應當在兩個或者兩個以上醫療器械臨床試驗機構中進行”的要求,取消了檢驗報告1年有效期的要求,有利于臨床試驗的順利開展。
為配合《規范》實施,進一步指導臨床試驗開展,國家藥監局制定了《醫療器械臨床試驗方案范本》《醫療器械臨床試驗報告范本》《體外診斷試劑臨床試驗方案范本》《體外診斷試劑臨床試驗報告范本》《醫療器械/體外診斷試劑臨床試驗嚴重不良事件報告表范本》《醫療器械/體外診斷試劑臨床試驗基本文件目錄》等六個文件,與《規范》同步實施。
3月31日,國家藥監局《關于實施〈醫療器械臨床試驗質量管理規范〉有關事項的通告》(2022年第21號)明確:自2022年5月1日起,尚未通過倫理審查的醫療器械臨床試驗項目,應當按照《規范》進行調整后開展臨床試驗;對于已經通過首次倫理審查的項目可以按照原相關文件要求開展工作。
文字編輯:劉莉
版式編輯:于成林
【來源:醫藥經濟報】
-
建設銀行上海市分行:疫情期間個人貸款業務可延期還款
頭條 22-04-07
-
公募管理費首破千億元大關,13家基金公司2021年凈利潤超10億元
頭條 22-04-07
-
快訊!鄭州眾智科技4月14日創業板上會
頭條 22-04-07
-
全力守“滬”!國內這些快遞企業化身“逆行俠”抗疫保供
頭條 22-04-07
-
快訊!牧原股份回應相關負責人買賣可轉債構成短線交易
頭條 22-04-07
-
首次全國醫藥集采機構工作會召開
頭條 22-04-07
-
江蘇昆山市靜默期延長4天!
頭條 22-04-07
-
立方風控鳥·晚報(4月7日)
頭條 22-04-07
-
4月9日起,焦作各中小學、幼兒園錯峰返校復學!
頭條 22-04-07
-
新鄉化纖2021年凈利大增15倍,擬派現1.47億元
頭條 22-04-07
-
雙匯發展擬使用30億元閑置資金進行現金管理
頭條 22-04-07
-
上海一退休老人被誘導貸款370萬買保險 每年支付利息超20萬
頭條 22-04-07
-
中原傳媒擬購買不超過25億元理財產品
頭條 22-04-07
-
2021年周口市人口發展報告出爐:女性比男性多5.5萬
頭條 22-04-07
-
地域特色美食如何出圈?三全食品布局預制菜細分賽道 | 豫見預制菜⑩
頭條 22-04-07
-
馬自達中國發布人事變動通告,中島徹出任馬自達中國董事長
頭條 22-04-07
-
保糧食+保能源,交通銀行推出18條舉措全力支持吉林省抗疫
頭條 22-04-07
-
新鄉中新融資租賃公司獲批設立,注冊資本金2億元
頭條 22-04-07
-
2022年4月基金從業資格考試推遲舉辦
頭條 22-04-07
-
江蘇無錫一居民樓發生坍塌,現場有人員受傷
頭條 22-04-07
-
中原高速完成發行8億元超短融,利率2.27%
頭條 22-04-07
-
河南金星啤酒集團籌劃上市,計劃2025年達成上市目標
頭條 22-04-07
-
河南返鄉置業創業補貼怎樣申報?答復來了
頭條 22-04-07
-
央行:3月末外匯儲備報31879.9億美元,環比減少258.37億美元
頭條 22-04-07
-
涉及汽車超12萬輛!特斯拉召回部分進口及國產Model 3電動汽車
頭條 22-04-07
-
總投資423.09億元,河南確定一批工業綠色低碳發展重點項目
頭條 22-04-07
-
駐馬店“十四五”航空經濟發展規劃公布
頭條 22-04-07
-
青海省委常委,省人大常委會副主任、黨組書記李杰翔被查
頭條 22-04-07
-
駐馬店發文:研究設立城鎮化發展基金,新建改擴建20所普通高中學校
頭條 22-04-07
-
總投資約1392.73億元,駐馬店市中心城區285個城建項目名單公布
頭條 22-04-07
-
企鵝電競發布退市公告:6月7日23時59分終止運營
頭條 22-04-07
-
麗水公積金貸款最高調整為70萬元,首套房首付比例降為20%
頭條 22-04-07
-
鄭州緊急提醒:近期盡量不購買、不轉銷韓國進口服裝等進口物品
頭條 22-04-07
-
朱克力:新就業“溫床”
頭條 22-04-07
-
收好這份大禮包!2022年南陽市20件民生實事出爐
頭條 22-04-07
-
疫情導致無法工作,房貸不能推遲還?三大銀行回應
頭條 22-04-07
-
黑歷史有救了!淘寶賬號能改名了:趕緊行動
頭條 22-04-07
-
河南發布2022年跨境人民幣結算優質企業名單,199家上榜
頭條 22-04-07
-
萬億險資最新持倉路徑曝光:重倉銀行股,降低地產股持倉,加倉新能源!
頭條 22-04-07
-
文旅部等六部門:推動文化產業賦能鄉村振興
頭條 22-04-07
-
原國家糧食局黨組成員、副局長徐鳴被提起公訴
頭條 22-04-07
-
一圖掌握河南185個開發區
頭條 22-04-07
-
周口、商丘兩家平臺公司40億元公司債獲審核通過
頭條 22-04-07
-
漯河發布19號通告:恢復堂食,開放影劇院、美容美發等場所
頭條 22-04-07
-
定增8億元~10億元,黃河旋風持續加碼培育鉆石
頭條 22-04-07
-
河南昨日新增本土無癥狀感染者36例
頭條 22-04-07
-
什么情況?但斌微博被禁言半年,雪球賬號剛剛也被禁!旗下產品仍低倉位運作
頭條 22-04-07
-
國家衛健委:昨日新增本土確診病例1284例 本土無癥狀感染者21711例
頭條 22-04-07
-
總投資816.64億元!周口145個項目集中簽約開工投產
頭條 22-04-06
-
80后馬軍祥任潞安礦業董事長
頭條 22-04-06
-
總投資765.7億元!新鄉183個項目集中簽約開工投產
頭條 22-04-06
-
2022胡潤全球房地產企業家榜:李嘉誠領銜,Top10中8名來自中國
頭條 22-04-06
-
總投資14919億元,河南省2354個項目集中簽約開工投產
頭條 22-04-06
-
弄虛作假、隱瞞行程!周口淮陽區一貨車司機被立案偵查
頭條 22-04-06
-
總投資14.76億元,上汽鄭州發動機一期項目投產
頭條 22-04-06
- NMPA新修訂《醫療器械臨床試驗質量管理規范2022-04-07
- 只要身體好,長期飲酒真的沒問題嗎?痛風如2022-04-07
- 高新區行政執法大隊開展清明節期間環境秩序2022-04-07
- 建設銀行上海市分行:疫情期間個人貸款業務2022-04-07
- A級以上89家!洛陽社區養老服務設施等級評2022-04-07
- 樂在田間,“食”在有趣——鄭州市實驗幼兒2022-04-07
- 公募管理費首破千億元大關,13家基金公司202022-04-07
- 禁毒科普|禁毒知識點學起來~2022-04-07
- 快訊!鄭州眾智科技4月14日創業板上會2022-04-07
- 全力守“滬”!國內這些快遞企業化身“逆行2022-04-07
- 亞馬遜簽大單發射太空互聯網 欲和馬斯克的2022-04-07
- 江蘇睢寧縣在集中隔離人員核酸篩查中發現32022-04-07
- 【地評線】紫金e評:致敬!戰“疫”中每份2022-04-07
- 【凡人微光】這次上海疫情,他們來了!2022-04-07
- 【凡人微光】7500名江蘇援滬醫護人員再赴上2022-04-07
- 【凡人微光】無人機開辟空中抗疫航線 巡檢2022-04-07
- 紀錄片《幕后》第四集:引導員(下)2022-04-07
- 中寧縣法院:耐心溝通解難題 打開心結巧執2022-04-07
- 張灣區精神衛生中心專家走進柏林小學開展心2022-04-07
- 物化院2項活動斷裂及地熱資源研究項目獲自2022-04-07
- 四川新規:5類固體廢物應開展危險廢物鑒別2022-04-07
- 李玉剛到省水利廳調研2022-04-07
- 潛心教研,“語”你同行——源匯區第三實驗2022-04-07
- 反欺凌 防暴力——源匯區實驗學校開展校園2022-04-07
- 快訊!牧原股份回應相關負責人買賣可轉債構2022-04-07
- 首次全國醫藥集采機構工作會召開2022-04-07
- 江蘇昆山市靜默期延長4天!2022-04-07
- 國際信息科學與技術學會會刊(JASIST)發表2022-04-07
- 多地出臺取消競賽加分的文件 讓每一個孩子2022-04-07
- 立方風控鳥·晚報(4月7日)2022-04-07