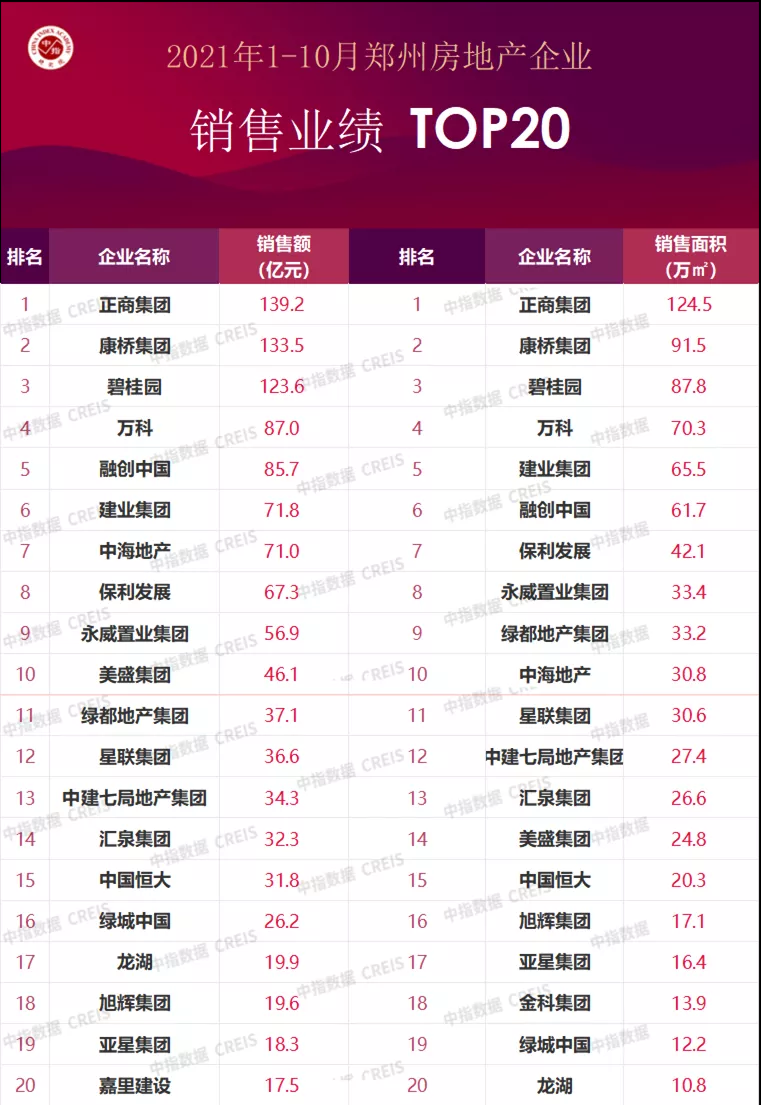
為提升藥品監管水平,將藥品監管各環節、全過程納入法治軌道,建立起相互銜接的規范制度體系,省政府近日印發《陜西省全面加強藥品監管能力建設若干措施》。

完善藥品安全風險會商機制
落實藥品監管事權劃分,明確省、市、縣三級監管事權清單、責任清單、協同清單,強化藥品全生命周期監管。充分發揮市場綜合監管與藥品專業監管優勢,挖掘最大效能,構建藥品監管統一領導、事權合理劃分、上下聯動、協同配合的體制機制。完善省、市、縣藥品安全風險會商機制。
提高技術審評能力。瞄準我省醫藥產業發展戰略需求,加強省藥品技術審評中心建設,助力藥品、醫療器械和化妝品產業創新發展。建立與國家藥品、醫療器械審評合作共建機制,優化溝通交流方式和渠道,充實專業技術力量,為我省藥品、醫療器械和化妝品研發提供優質便捷服務。優化應急和創新藥品醫療器械研審聯動工作機制,鼓勵新技術應用和新產品研發。
推動建設藥品安全“監管大平臺”
按照國家藥監局“十四五”藥品監管信息化規劃要求,在大市場監管平臺下,整合完善現有信息系統,推動建設藥品安全“監管大平臺”“追溯大系統”和“藥械化大數據”。
推動“監管大平臺”建設。進一步迭代升級智慧監管平臺,全力推進數字監管向日常監管、稽查執法、監督抽檢、信用評級等核心業務延伸,充分發揮藥監云平臺作用,方便群眾和企業辦事。
推動“追溯大系統”建設。按照統一的藥品信息化追溯標準,落實藥品上市許可持有人追溯責任。整合藥品生產、流通、使用等環節的追溯信息,加強與醫療、醫保等領域的銜接,逐步實現藥品來源可查、去向可追,充分發揮追溯數據在風險防控、產品召回、應急處置等工作中的作用,提升藥品監管精細化水平。積極推進醫療器械唯一標識(UDI)的實施。
推動“藥械化大數據”建設。建立全省藥械化大數據中心,有效匯聚監管數據和企業注冊、生產、流通、使用信息,建立基于大數據分析的藥械化風險預警模型和監管檔案數據庫,形成精準化、智慧化監管新模式。實施藥品、醫療器械和化妝品電子監管“一企一檔”,推進品種檔案建設與應用,實現省、市、縣信息共享共用。推動實現衛生健康、醫保、公安等各部門監管信息互聯互通。
實施全生命周期監管
打通研發、生產、流通、使用全生命周期、全鏈條監管各環節,暢通問題全過程追溯渠道,形成監管閉環。藥監部門在研發階段提前介入,建立貫通藥品生產、流通、使用各環節的“一企一檔”監管檔案,形成責任清單,監管信息共享,監管責任連帶。
提升監管效能。持續深化“放管服”改革,優化審批流程,壓縮審批時限,推進藥品注冊核查和許可檢查同步進行,注冊審評、檢查、檢驗、審批并聯實施。落實藥品上市許可持有人和醫療器械注冊人制度。繼續深化“百人幫百企”行動,著力解決藥品、醫療器械和化妝品企業在研發、臨床試驗、注冊申報、上市后變更等環節存在的“難點”“堵點”。 記者 馬昭
-
鄭州最新高速查驗政策::省內低風險入鄭,不再查驗核酸
頭條 22-01-29
-
鄭州市發布38號通告:全市封控區、管控區、防范區全部解除
頭條 22-01-29
-
立方風控鳥·早報(1月29日)
頭條 22-01-29
-
河南昨日新增本土確診病例1例
頭條 22-01-29
-
以鄭州航院為依托組建航空航天大學
頭條 22-01-29
-
央行今日開展票據互換(CBS)操作,操作量50億元
頭條 22-01-29
-
重磅出爐!基金代銷百強格局生變,"宇宙行"居然跌出前三
頭條 22-01-29
-
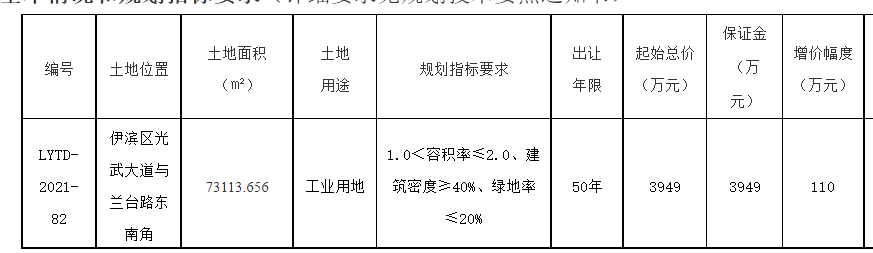
洛陽市伊濱區:錨定千億目標 聚力打造科技產業新城
頭條 22-01-29
-
鄭州地鐵今起調整行車間隔
頭條 22-01-29
-
隔夜歐美·1月29日
頭條 22-01-29
-
鄭州中風險地區清零
頭條 22-01-29
-
“五洋債案”賠付環節起波瀾:部分中介稱后續無力負擔,提替代方案
頭條 22-01-28
-
由盈轉虧,風神股份預計2021年虧損9000萬至1.1億元
頭條 22-01-28
-
順豐預計2021年盈利下降40%~43%
頭條 22-01-28
-
濮耐股份預計2021年盈利下滑超70%
頭條 22-01-28
-
國家發改委將采取有力措施加強鐵礦石價格調控監管
頭條 22-01-28
-
中航光電:目前防務領域處于產能飽和狀態
頭條 22-01-28
-
刷新歷史紀錄!安鋼集團2021年營收763億元,增長51.69%
頭條 22-01-28
-
立方風控鳥·晚報(1月28日)
頭條 22-01-28
-
首筆屋頂分布式光伏發電項目資金落地 興業銀行鄭州分行聚焦“雙碳”目標再發力
頭條 22-01-28
-
在線參展人次達1800萬!2022數字河南云博會正式啟幕
頭條 22-01-28
-
搜索“核酸檢測” 高德地圖一鍵預約周邊的核酸檢測服務
頭條 22-01-28
-
證監會:對招股書存在表述不清、邏輯混亂等情形的,采取監管措施或紀律處分
頭條 22-01-28
-
國內機票燃油附加費2月5日恢復征收
頭條 22-01-28
-
河南提前下達2022年困難群眾救助補助資金72.5億元,加大兜底保障力度
頭條 22-01-28
-
東方財富2021年預盈利超82億元,同增71.62%~86.27%
頭條 22-01-28
-
扭虧為盈!黃河旋風預計2021年扣非凈利1.06億元
頭條 22-01-28
-
房企并購債破冰,行業集中大幕拉開,后半場關鍵還看銷售端
頭條 22-01-28
-
北京銀行與中央財經大學簽約,共同設立雙碳與金融研究中心
頭條 22-01-28
-
春節儀式感滿滿!春晚畫面提前曝光?網友:太真實了
頭條 22-01-28
-
安陽鋼鐵擬與建信金租開展5億元融資租賃業務
頭條 22-01-28
-
濮陽保障農民工春節有序流動 非濮籍員工留崗每人發6張卡
頭條 22-01-28
-
河南累計發放省內通行證21690張,強化物資重點保供
頭條 22-01-28
-
原中國印鈔造幣總公司黨委委員、董事陳耀明被逮捕
頭條 22-01-28
-
春節期間,鄭州3.6萬個路邊車位免費停
頭條 22-01-28
-
暖心!436封書信號召河南轄區主體攜手促進資本市場健康發展
頭條 22-01-28
-
總投資7.13億元!河南一500千伏電網優化工程環評獲批
頭條 22-01-28
-
國家發改委:嚴厲打擊煤炭現貨、期貨市場違法違規價格行為
頭條 22-01-28
-
“寧王”暴拉700億!創業板指V型反彈,信心回來了?
頭條 22-01-28
-
中光學:公司生產經營正常 產線飽滿 暫未受到本輪河南其他地方疫情影響
頭條 22-01-28
-
關于河南省道路貨運綠色低碳轉型發展的思考 | 龍志剛專欄
頭條 22-01-28
-
留鄭過年福利來了:鄭好辦上可領10GB流量等福利
頭條 22-01-28
-
中歐班列(鄭州)至匈牙利布達佩斯線路今日首發
頭條 22-01-28
-
全力護航冬奧會!950輛宇通客車和服務保障團隊已就位
頭條 22-01-28
-
速看!開封發布最新入汴政策
頭條 22-01-28
-
2021年鄭州市對外貿易進出口總額5892.1億元,增長19.1%
頭條 22-01-28
-
河南0!安陽0!本輪疫情河南首次單日0新增
頭條 22-01-28
-
雙匯發展投資總額增至100億元,增幅354%
頭條 22-01-28
-
國家航天局:將培育發展太空旅游等太空經濟新業態
頭條 22-01-28
-
河南農開5億元中票完成發行,利率3.6%
頭條 22-01-28
-
央企年度工作會議密集召開,聚焦四大關鍵詞
頭條 22-01-28
-
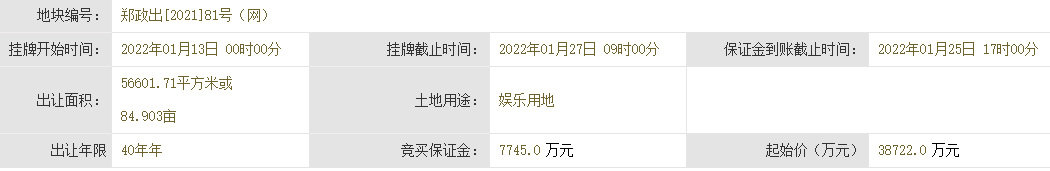
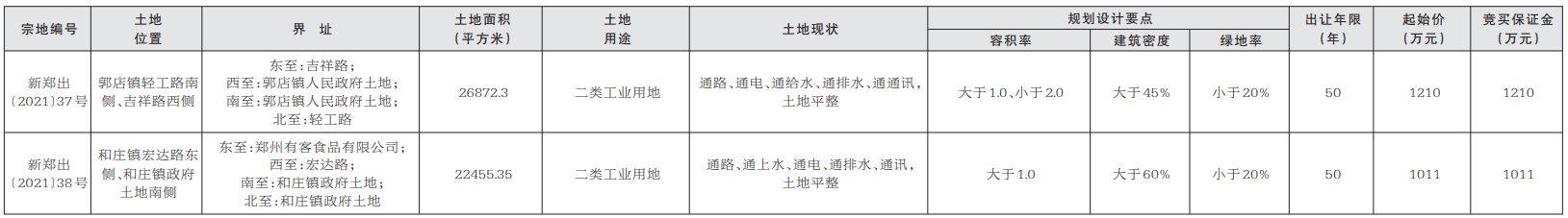
成交價1.04億元!鄭州2宗86.27畝工業用地完成出讓
頭條 22-01-28
-
立方風控鳥·早報(1月28日)
頭條 22-01-28
-
美國去年四季度GDP環比增6.9%,全年GDP增5.7%!美股高開高走
頭條 22-01-28
-
駐馬店農業產業化國家重點龍頭企業達7家
頭條 22-01-28
- 陜西發布全面加強藥品監管能力建設若干措施2022-01-29
- 海南省建立職工基本醫療保險門診共濟保障機2022-01-29
- 海南省多措并舉筑牢春節“防疫墻” 個人自2022-01-29
- 去年海南省工業投資首次突破500億元 制造2022-01-29
- 海南省農民人均可支配收入達到1.8萬元 增2022-01-29
- 2021年甘肅外貿進出口490.9億元 同比增長28.4%2022-01-29
- 蘭州市生產總值2021年達到3231.29億元 同2022-01-29
- 合肥野生動物園春節期間免費開放 游客必須2022-01-29
- 國內首次!滬蘇浙皖聯合出臺氣象領域輕微違2022-01-29
- 深圳市發布通告:離深人員須憑“綠碼”出行2022-01-29
- 深圳市建筑工務署去年全年完成投資275.6億2022-01-29
- 十年十倍股有哪些特征 專家支招如何挖掘長2022-01-29
- 美元指數連日大漲 人民幣匯率創新高后回落2022-01-29
- 1月份主動權益基金最高收益未到10% 股票型2022-01-29
- 牛年A股收官虎年期待虎步 節后市場將企穩2022-01-29
- 《深圳市全面推行林長制的實施方案》發布2022-01-29
- 深圳2021年經濟發展“成績單”出爐 GDP首2022-01-29
- 去年天津市外貿進出口總值創歷史新高 首次2022-01-29
- A股牛年最后一個交易日 三大指數弱勢收官2022-01-29
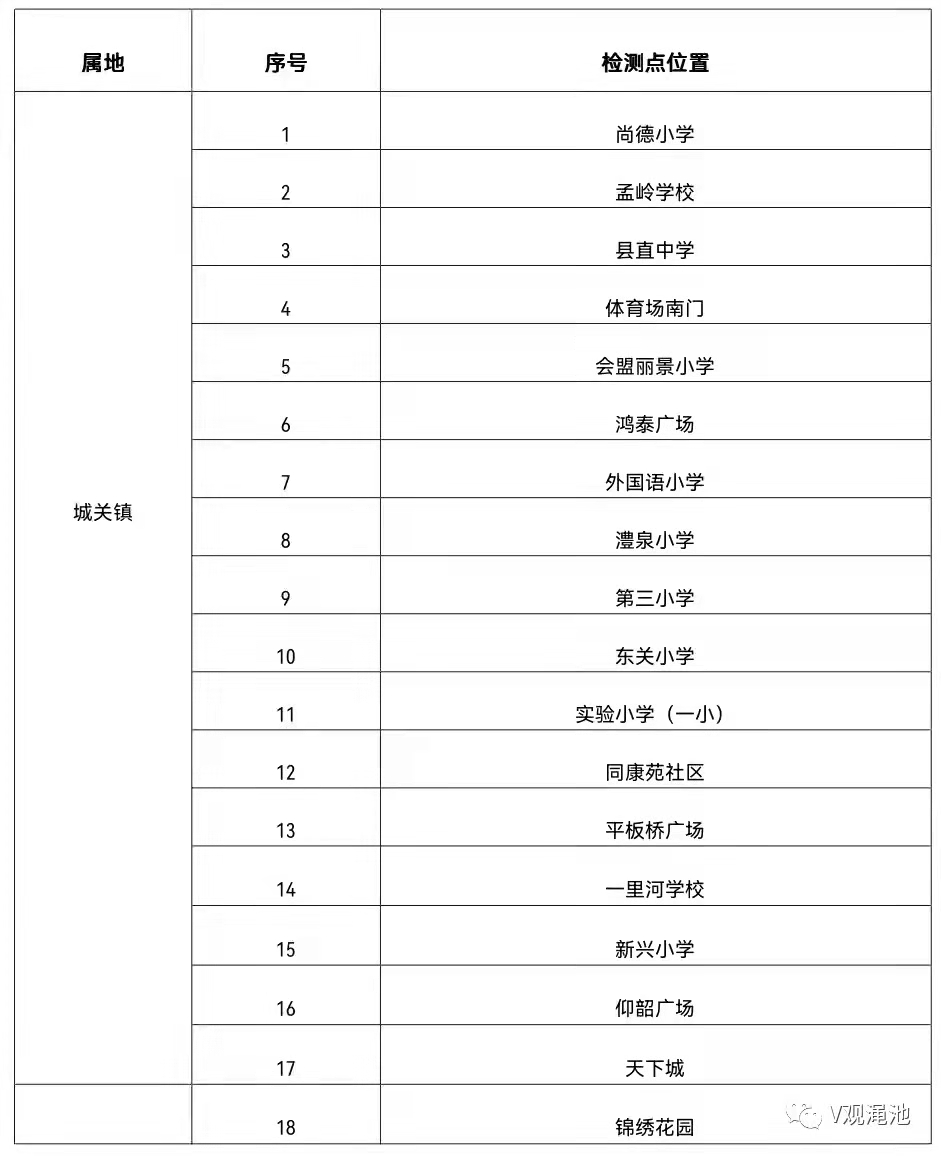
- 三門峽市澠池縣發布通告:開展城區居民核酸2022-01-29
- 鄭州最新高速查驗政策::省內低風險入鄭,2022-01-29
- 17年后河南高速公路條例擬修訂 摩托車禁上2022-01-29
- 河南27條高速因降雪禁止車輛上站 提前規劃2022-01-29
- 何為真正的“鮮活”奶粉 旗幟奶粉用專利技2022-01-29
- 最新!新增本土病例37例,在這幾個地方2022-01-29
- 本土確診+37,其中18例在杭州2022-01-29
- 雨雪不斷 未來南方仍多陰雨雪天氣2022-01-29
- 安徽發布暴雪藍色預警2022-01-29
- 杭州市富陽區調整封控區、管控區、防范區2022-01-29
- 暴雪藍警發布:皖浙湘部分地區大雪,局地積2022-01-29